Elèctrode de vidre
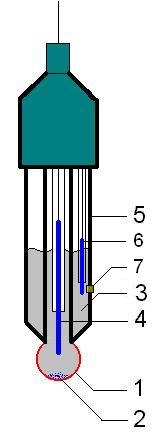
L'elèctrode de vidre és un tipus d'elèctrode constituït per un tub de vidre acabat a la part inferior en un bulb de parets molt fines, que actua com a membrana semipermeable als cations hidrogen, H+. S'empra per a la mesura del pH entre 0 i 13 unitats, i no és afectat per oxidants reductors, ni composts orgànics.[1]
La cel·la electroquímica que empra l'elèctrode de vidre consisteix en dos elèctrodes: 1) un elèctrode indicador de vidre i 2) un elèctrode de referència d'argent/clorur d'argent o de calomelans saturat; submergits en la dissolució de la qual se'n vol mesurar el pH. La seva representació és:
L'elèctrode de vidre consisteix en una membrana de vidre prima sensible al pH posada al final d'un tub de vidre de parets gruixudes o de plàstic. El tub conté un petit volum d'àcid clorhídric, HCl, diluït i saturat de clorur d'argent, AgCl, (la dissolució interna en alguns elèctrodes és una dissolució amortidora que conté anions clorur, Cl-). En aquesta dissolució un fil d'argent forma un segon elèctrode de referència d'argent/clorur d'argent, que es connecta a una de les terminals d'un dispositiu per mesurar el potencial o potenciòmetre. L'elèctrode de referència no inclòs dintre de l'elèctrode de vidre es connecta a l'altre terminal. De manera que en una cel·la electroquímica típica per mesurar el pH ens trobem dos elèctrodes de referència, un extern a l'elèctrode de vidre i l'altre intern.[2]
Història
[modifica]El primer elèctrode de membrana de vidre fou dissenyat el 1908 pels químics alemanys Fritz Haber i Zygmunt Klemensiewicz. Tanmateix publicaren l'article en el qual el descrivien el 1909,[3] per la qual cosa es pren aquest darrer any com el d'invenció de l'elèctrode de vidre. L'elèctrode original era molt semblant als elèctrodes actuals.[4]
El 1929 Duncan MacInnes i Malcolm Dole realitzaren una recerca per a millorar la composició del vidre per a la membrana i descobriren la composició de la membrana anomenada Corning 015.[5]
El 1934 el químic nord-americà Arnold Orville Beckman dissenyà el primer pH-metre, aparell que permet mesurar el pH emprant un elèctrode de vidre, i que fou comercialitzat el 1936, el mateix any que en comercialitzà un la companyia Radiometer de Dinamarca. Posteriorment la companyia d'instrumental de laboratori que fundà Beckman descobrí nous tipus de vidres per a elèctrodes.
Composició de la membrana
[modifica]Els vidres emprats per a les membranes no són higroscòpics, és a dir, que es poden hidratar. La composició del vidre Corning 015 és aproximadament 22% òxid de sodi, Na₂O, 6% òxid de calci, CaO i 72% diòxid de silici, SiO₂. La gruixa de la part més fina oscil·la entre 0,03 i 0,1 mm i presenta una resistència elèctrica entre 50 i 500 MΩ.[6]
El vidre és una estructura de grups de silicats i en els intersticis dels quals hi ha els cations per contrarestar les càrregues negatives dels silicats. Aquests cations són els que confereixen la mobilitat electrònica a través d'aquesta membrana. La membrana de vidre s'ha de mantenir hidratada per tal que respongui al pH, la quantitat d'aigua implicada és, aproximadament, uns 50 mg/cm³. L'efecte és reversible i si la membrana s'ha deshidratat es recupera la resposta de l'elèctrode de vidre després de submergir-lo diverses hores en aigua. El que produeix aquesta hidratació és una reacció d'intercanvi iònic entre els cations monovalents de la xarxa de vidre (els divalents i trivalents estan units amb més força i no es mouen) i els cations hidrogen de l'aigua, que està autoionitzada, segons l'equació:
La superfície de la membrana ben remullada consisteix, per regla general, en una capa de gel d'àcid silícic, amb una gruixa d'entre 10-4 i 10-5 mm.[6]
Potencials de membrana
[modifica]El potencial mesurat en la cel·la electroquímica, ∆E, correspon a la contribució de diversos potencials. N'hi ha tres que es mantenen constants en diferents mesures de pH: els dos dels dos elèctrodes de referència, Eref1 i Eref2, i un tercer que és el potencial d'unió a través del pont salí que separa l'elèctrode de referència de la dissolució de l'analit, Eps. Aquests tres potencials contribueixen al terme ∆E0.
La membrana de vidre serveix com a indicador de cations hidrogen perquè permet conduir el corrent elèctric. La conducció en l'interior de la capa de vidre hidratada implica el moviment dels cations hidrogen, H+. Els cations sodi, Na+, són els portadors de la càrrega elèctrica en l'interior sec de la membrana. La conducció a través de la interfase dissolució/vidre té lloc segons dues reaccions a la superfície externa del vidre (vidre1) en contacte amb la dissolució problema i a la superfície interna (vidre₂) en contacte amb la dissolució de l'elèctrode:
La superfície en la que té lloc una major dissociació es transforma en negativa respecte a l'altra superfície a on té lloc una menor dissociació. Es desenvolupa així un potencial límit Eb a través de la membrana. La magnitud del potencial límit depèn de la relació entre les activitats de les dues dissoluciones. És aquesta diferència de potencial la que serveix com a paràmetre analític en mesures potenciomètriques de pH amb un elèctrode de vidre. El potencial límit consta de dos potencials, E1 i E₂, cada un dels quals està associat amb una de les dues interfases vidre/dissolució. El potencial límit és simplement la diferència entre aquests dos potencials. Així el potencial límit Eb depèn només de les activitats del catió hidrogen de les dissolucions a ambdues superfícies de la membrana. Pels elèctrodes de vidre, l'activitat dels cations hidrogen en la dissolució interna a₂ es manté constant i la seva contribució s'engloba dintre del terme ∆E0, pel que es dedueix que el potencial límit és llavors una mesura de l'activitat del catió hidrogen en la dissolució externa, a1.[6] Aplicant l'equació de Nernst a 25 °C resulta que:
i per la definició de pH es pot escriure:
Potencial d'asimetria
[modifica]Si es col·loquen dissolucions idèntiques i elèctrodes de referència idèntics a un i l'altre costat de la membrana de vidre, el potencial Eb, hauria de ser zero. Tanmateix, hom pot mesurar un petit potencial, anomenat potencial d'asimetria, el qual canvia lentament amb el temps. Hi ha diverses causes que s'han apuntat per explicar-lo: diferències de tensió produïdes en les dues superfícies de vidre en el moment de la fabricació de la membrana, atacs mecànics o químics de la superfície i contaminació externa durant el seu ús. Per eliminar el seu efecte cal calibrar l'elèctrode freqüentment.[6]
Errors alcalí i àcid
[modifica]Les membranes donen errors que depenen del tipus de vidre per a dissolucions alcalines de pH majors de 9, es va incrementant a mesura que augmenta el pH i es fa molt marcat per a dissolucions de pH superior a 12 per a tots els tipus de membranes. És l'anomenat error alcalí o de sodi. La causa d'aquest error és que les membranes també responen a les concentracions dels cations monovalents dels metalls alcalins en dissolució, com ara Li+, Na+ i K+. Per una altra banda quan les dissolucions tenen pH per sota d'1 també donen errors. Les causes no són compreses. Tanmateix les determinacions habituals de pH es realitzen dintre de l'interval exempt d'errors. A més s'han dissenyat membranes específiques per a treballar en les zones d'error si calen determinacions en aquests casos.[6]
Referències
[modifica]- ↑ «Elèctrode de vidre». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Colomer, A «Estudi de nous elèctrodes selectius d'ions per apliaccions en continu». UPCommons. Universitat Politècnica de Catalunya.
- ↑ Haber, F.; Klemensiewicz, Z «Ober elektrische. Phasengrenzkrafte». Z. Phys. Chem., 67, 1909, pàg. 385-431.
- ↑ «pH-meter.info». [Consulta: 4 abril 2013].
- ↑ Cleaves K.S. «Ancillaires and Analyzers». [Consulta: 4 abril 2013].
- ↑ 6,0 6,1 6,2 6,3 6,4 Skoog, D.A; West, D.M. Análisis instrumental. México: Interamericana, 1984. ISBN 968-25-0858-4.






